感染性骨缺损在临床上非常常见,其致病菌主要为金黄色葡萄球菌[1]。交通事故和爆炸伤的增多使其发病率逐渐上升[2]。长期静脉应用抗生素治疗感染性骨缺损可导致身体毒性。载抗生素的聚甲基丙烯酸甲酯(polymethyl methacrylate,PMMA)已被广泛用于治疗骨感染性疾病[3]。PMMA的优点是可在局部获得较高的药物浓度,避免了静脉用药的副作用;其主要缺点是不可降解、不能释放全部药物[4]。基于目前研究现状,研发一种具有良好生物相容性、药物缓释性能、可控吸收、良好生物力学性能的骨修复材料对治疗感染性骨缺损具有重要意义。
纳米羟基磷灰石(nano-hydroxyapatite,n-HA)的结构与人体骨组织相似[5],其具有良好的生物活性和相容性,n-HA被认为是最有前途的骨修复材料之一[6]。n-HA负载万古霉素复合材料已成功用于治疗感染性骨缺损[7]。聚氨酯(polyurethane,PU)是一种可生物降解的材料,已被广泛用于骨组织工程[8]。纳米羟基磷灰石/聚氨酯(n-HA/PU)多孔骨修复支架材料具有优良的生物相容性和成骨作用。介孔二氧化硅纳米粒子(mesoporous silica nanoparticles,MSNs)由Kresge等[9]首次发现,具有大孔体积、可控孔径、高比表面积等特点,已被广泛应用于生物纳米技术和纳米医学领域[10]。许多药物和生物分子,如DNA或siRNA封装在MSNs中用于治疗癌症[11]。左氧氟沙星是一种从氧氟沙星中分离出来的Ⅲ类氟喹诺酮类抗生素。其抗菌性能是氧氟沙星的2倍,具有低分子量,通过静电吸引易于与MSNs结合。本研究以多孔n-HA/PU复合支架作为载体,将含有抗生素的MSNs分布于其多孔表面,合成了一种新型介孔硅纳米微球载药控释抗菌骨修复材料,并评价该新型复合支架材料的体外缓释性能及其治疗感染性骨缺损的疗效。
1.1 材料
24只新西兰兔由菏泽医学专科学校动物实验中心提供,其中雌性12只,雄性12只,体重在2 ~ 4 kg之间,单笼饲养。动物生产许可证号:[SCXK(鲁)-2018-0006],动物使用许可证号:[SYXK(鲁)-2019-0019]。本实验研究经菏泽医学专科学校附属医院伦理委员会审核并通过(2021-016),并严格遵守“3R”原则。
蓖麻油、甘油、十六烷基三甲基溴化铵(CTAB)、原硅酸四乙酯(TEOS)(中国阿拉丁有限公司);1,4-丁二醇(BDO)和辛酸亚锡(中国成都科龙有限公司);左氧氟沙星、甲醛溶液、乙酸乙酯(中国国药集团化学试剂有限公司);聚甲基丙烯酸甲酯粉末(Palacos R+G,德国Heraeus Medical GmbH公司)。高效液相色谱仪(LC-2010AHT,日本岛津公司);超声波清洗器(KQ2200B,昆山市超声仪器有限公司);高速离心机(D-37520,美国Sigma公司);循环恒温水浴锅(TB-85,日本岛津公司);组织匀浆机(T10 basic S25,德国IKA公司);Micro CT扫描仪(μCT40,瑞士Scanco医疗);Scanco医疗系统(SC5073,μCTv6.1版,瑞士Scanco医疗);硬组织切磨系统(E300CP,德国EXAKT公司)。
1.2.5 植入材料
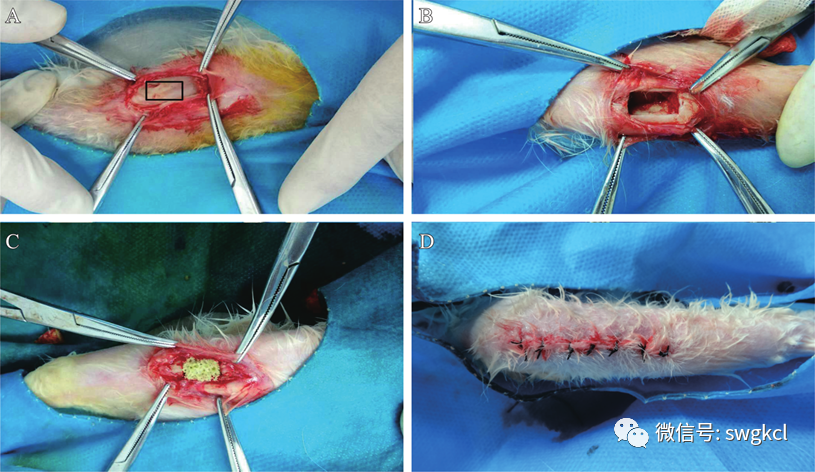
图1 植入材料的过程:A. 暴露胫骨,选定清创区域与大小(10 mm×6 mm);B. 彻底清创并开窗;C. 植入复合支架材料;D. 逐层缝合
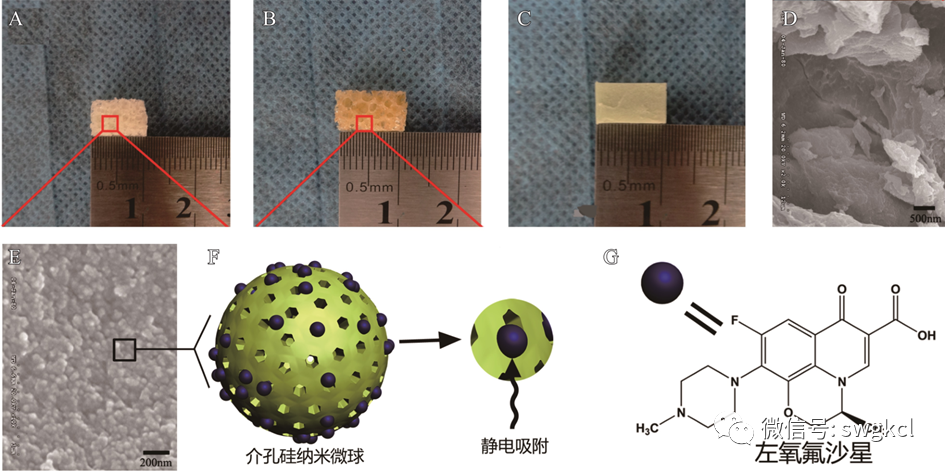
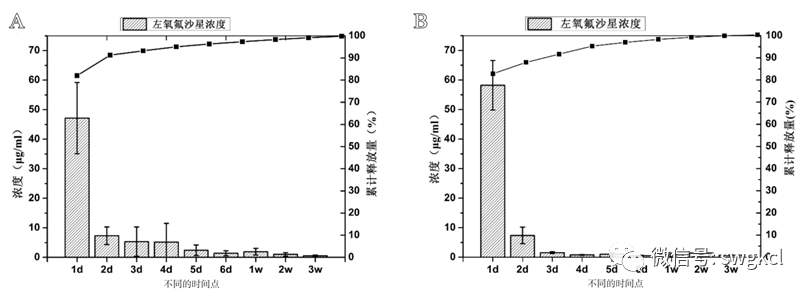
图2 新合成的多孔复合支架材料:A. 空白n-HA/PU支架材料;B. 载抗生素后的n-HA/PU材料;C. 载抗生素的PMMA;D. 空白n-HA/PU的扫描电镜图;E. 1 mg Lev/n-HA/PU材料的扫描电镜图;F. 左氧氟沙星与MSNs结合的模式图;G. 左氧氟沙星的分子结构
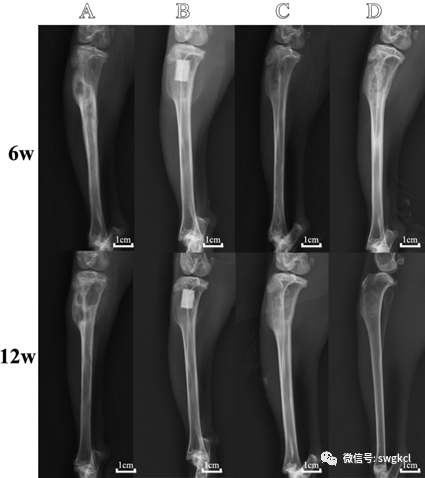

在植入后6周时,单纯清创组可见骨破坏和骨缺损。n-HA/PU组和1 mg Lev/n-HA/PU组的复合支架保持完整没有降解。在n-HA/PU组和1 mg Lev/PMMA组中,可见支架材料周围少量的新骨形成。在1 mg Lev/n-HA/PU组的支架周围观察到新的骨小梁形成。在植入后12周的时间点,单纯清创组表现为胫骨局部骨缺损,无明显新生骨。在1 mg Lev/n-HA/PU组中,新生的骨小梁紧密地附着在复合支架上,几乎填满了整个骨髓腔。然而在n-HA/PU组和1 mg Lev/PMMA组中只能观察到很少的新生骨小梁。各组植入后的3D重建如图5所示。
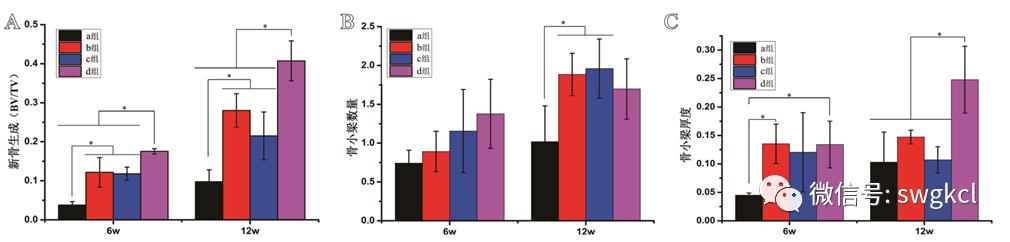
在植入后6周时,1 mg Lev/n-HA/PU组的新骨生成量(BV/TV)均与其余三组有统计学差异(P<0.05)。在植入后12周时,1 mg Lev/n-HA/PU组的新骨生成量(BV/TV)均高于其余三组(P<0.05,见图6)。同时,n-HA/PU组与1 mg Lev/PMMA组的新骨生成均高于单纯清创组(P<0.05)。在植入后6周时,各组之间新生骨小梁的数量比较,差异无统计学意义(P>0.05)。在植入后12周时,n-HA/PU组与1 mg Lev/PMMA组的新生骨小梁的数量均高于单纯清创组(P<0.05)。在植入后12周时,1 mg Lev/n-HA/PU组的新生骨小梁的厚度均与其余三组差异有统计学意义(P<0.05)。
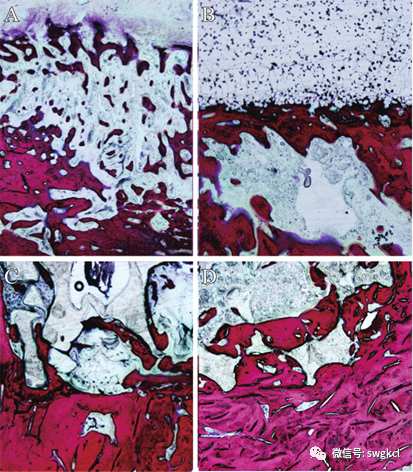
在植入后12周时由于炎症反应导致骨破坏,单纯清创组骨质较稀疏(见图7A)。在1 mg Lev/PMMA组材料表面,可见明显界限,有新生骨小梁迁延生长(见图7B)。在n-HA/PU组、1 mg Lev/n-HA/PU组材料的内部,新生骨小梁沿孔隙生长。其中1 mg Lev/n-HA/PU组材料与骨小梁相互缠绕,结合紧密(见图7)。
感染性骨缺损的治疗需彻底清除死骨和感染的软组织,同时静脉应用抗生素4 ~ 6周[18]。其主要缺陷是局部的抗生素浓度达不到最小抗菌浓度,同时长期静脉应用抗生素会对身体产生毒性,给患者带来巨大的经济负担,对外科医生来讲是一个巨大的挑战。因此,局部应用抗生素治疗感染性骨缺损成为了骨科学者研究的热点。
本研究中,笔者将负载左氧氟沙星的MSNs与n-HA/PU相结合,合成了一种新型复合支架材料,用于治疗感染性骨缺损。体外实验证实了其具有良好的药物缓释性能。将其植入动物体内12周后,新型复合支架材料具有良好生物相容性、抗感染能力、骨诱导能力,以期为感染性骨缺损的治疗提供新的解决方案。
技术服务咨询 步经理 18910422384
 官方微信
官方微信艾佧科技(北京)有限公司 地址:北京市经济技术开发区地盛南街1号1幢3041室
2020@ 艾佧科技(北京)有限公司 京ICP备10236589号