天津医科大学学报
天津医科大学肿瘤医院肿瘤研究所生物化学与分子生物学研究室,国家恶性肿瘤临床医学研究中心,天津市恶性肿瘤临床研究中心,天津市肿瘤防治重点实验室,乳腺癌防治教育部重点实验室,天津 300060
目的:探讨骨骼发育及矿化过程,构建骨矿化小鼠实验动物模型 。方法:采用甲状旁腺激素(PTH)(1-34)经腹腔注射,诱导6周龄 NOD-SCID 雌性小鼠成骨细胞分化及骨组织矿化,从而构建骨矿化小鼠实验动物模型。进一步应用Micro-CT 检测骨密度,应用钙黄绿素和盐酸四环素荧光标记检测骨矿化沉积率,应用冯库萨染色鉴定钙盐沉积,并应用马松染色检测骨胶原容积分数,以鉴定小鼠骨组织矿化水平,确定骨矿化小鼠模型是否构建成功。结果:Micro-CT检测发现,PTH(1-34)诱导20d 可以显著增加骨小梁相对体积分数(BV/TV,t=9.473,P<0.001)和骨小梁厚度(Tb.Th,t=18.64,P<0.001),显著减少骨小梁间距(Tb.Sp, t=7.794,P<0.01)。双荧光标记显示,PTH(1-34)处理后骨矿化沉积率(MAR)显著提高(t=29.99,P<0.001)。冯库萨染色显示,PTH (1-34)处理组冯库萨阳性面积(VK.A)显著增加(t=2.914,P<0.05)。马松染色显示,PTH(1-34)处理后胶原容积分数(CVF)显著提升(t=13.94,P<0.001)。结论:PTH(1-34)可有效诱导小鼠骨骼矿化,成功构建骨矿化小鼠实验动物模型。关键词 甲状旁腺激素(1-34);骨矿化;骨密度;实验动物模型骨骼不仅是人体的支架结构,还在矿物质储存、造血和机体免疫等方面发挥重要的调控作用。骨稳态是由成骨细胞骨形成和破骨细胞骨吸收相互协同从而达到的稳定状态,是成年人骨骼健康的基础。成骨细胞分化和骨矿化是骨组织形成中的关键过程。成骨细胞起源于骨髓间充质干细胞,经过骨祖细胞、前成骨细胞,逐渐分化成熟为功能性的成骨细胞[1-2]。分化成熟的成骨细胞大量合成并分泌骨基质蛋白,随着骨基质的积累,矿化过程随之启动,羟基磷灰石等无机钙盐沉积在骨基质上,逐渐形成骨组织矿化[3-4] 。终末分化的成骨细胞被矿化骨 基质包埋形成骨细胞,或转化为不活跃的骨衬里细胞。成骨细胞在中晚期分化阶段释放的基质外囊泡也能诱导成骨矿化[5]。病理条件下,骨组织细胞的活性和骨矿化程度可以改变骨微环境,不仅会导致骨质疏松[6-7]、骨软化症[8]等疾病,还能调控肿瘤细胞在骨组织中定植和转移[9-11]。甲状旁腺激素(PTH)是一种由甲状旁腺分泌的多肽激素,具有调节骨代谢的功能。在正常生理条件下,PTH能够调节血钙、磷水平,从而维持钙和磷的代谢平衡,促进正常骨代谢。合成的PTH(1-34)由PTHN端前34 个氨基酸组成,目前主要用于治疗骨质疏松症[12-13]。PTH(1-34)可提高患有特发性骨质疏松症的绝经前妇女血清中骨凝集素水平,后者是一种成骨因子,通过促进成骨分化来维持成人的骨形成[14]。PTH(1-34)还可通过增加前成骨细胞、成骨细胞、衬里细胞的数量以及加速成骨分化促进骨形成,从而使骨量增加[15-17]。PTH(1-34)不仅可以刺激前成骨细胞和衬里细胞的增殖和分化,还可以通过减弱破骨细胞的活性来抑制骨吸收[18],进而促进骨矿化。PTH(1-34)可能还通过增加骨基质中钙离子的浓度间接促进矿化[19-20]。为了探讨骨骼发育及矿化过程,本项研究拟采用PTH(1-34)诱导小鼠成骨细胞分化以及骨骼矿化,构建骨矿化小鼠实验动物模型,以期为骨微环境的生理、病理及疾病治疗提供动物模型和实验基础。1.1 材料 6只雌性6周龄 NOD-SCID 免疫缺陷小鼠购自江苏南京集萃药康生物科技股份有限公司,小鼠体重均等,实验动物许可证号: SYXK(津) 2023-0001;PTH(1-34)购自 MCE 公司;盐酸四环素和钙黄绿素购自北京索莱宝科技有限公司;EDTA 脱钙液购自生工生物工程(上海)股份有限公司。 本研究通过天津医科大学肿瘤医院实验动物伦理委员会审查(伦理编号:AE-2022093),依据动物伦理的相关规定实施。1.2 动物实验 按照简单随机抽样,将6只小鼠随机分为两组:对照组和 PTH(1-34)处理组,每组3只。PTH(1-34)处理组每天同一时间腹腔注射 PTH(1-34)100 μg/kg,持续20d 。对照组注射等量溶剂PBS。所有小鼠在处死前第13、14天,分别皮下注射盐酸四环素(25 mg/kg);小鼠处死前第3、4天,皮下注射钙黄绿素(5 mg/kg)。小鼠全程饲养于SPF级动物实验室,实验地点为天津医科大学肿瘤医院实验动物中心。在注射PTH(1-34)20d后,处死小鼠,解剖并分离后肢胫骨及股骨,用4%甲醛固定骨组织。1.3 Micro-CT 经腹腔注射PTH(1-34)20d后,采 用 Micro-CT 检测和分析小鼠骨密度。取固定后的小鼠右侧股骨,采用Siemens公司InveonTM系统的 Micro-CT 扫描仪对股骨进行扫描并三维重建骨组织形态。选择股骨远侧干骺端区域进行骨组织形态计量学分析。分析骨小梁相对体积分数(BV/TV)、骨小梁间距(Tb.Sp)和骨小梁厚度(Tb.Th),评价骨密 度和骨量。1.4 盐酸四环素-钙黄绿素双荧光 小鼠右侧股骨完成Micro-CT 后,在福尔马林中固定48h,之后用流水冲洗24h,进一步用75%、95%、100%梯度乙醇进行脱水处理,最后用Technovit 7200 树脂进行样本包埋。采用德国EXAKT公司硬组织切片机对股骨进行不脱钙硬骨组织切片,切片厚度为50μm,用德国EXAKT400S磨片机依次使用320、800、1200目砂纸将切片磨至厚度为25μm,最后用4000目砂纸对打磨好的切片进行抛光。采用荧光显微镜(ZEISS,德国)观察盐酸四环素和钙黄绿素双色荧光。硬组织切片中的盐酸四环素发出黄色荧光,反映小鼠处死前14d时的矿化骨质形成;钙黄绿素发出绿色荧光,标示小鼠处死前4d时的矿化骨质形成。在低倍镜下对每只小鼠右后肢股骨切片的远侧干骺端同一位置拍照(放大倍数50×) ,用Image J 软件测算钙黄绿素荧光面积(Calcein Area,Ca.A)反映小鼠临终时的成骨细胞活性和骨质矿化水平。在高倍镜下(400×)拍摄小鼠右后肢股骨远侧干骺端盐酸四环素-钙黄绿素双荧光标记图片,每张切片拍摄3个随机视野,采用ImageJ软件测量盐酸四环素和钙黄绿素荧光间距代表小鼠注射两种荧光之间10 d的新生矿化骨量,用于计算骨矿化沉积率(MAR)。MAR=荧光间距/10。1.5 冯库萨染色(Von Kossa staining) 对小鼠股骨的硬骨组织切片进行冯库萨染色。后者利用金属置换反应,用硝酸银溶液中的银离子将组织中的钙离子置换出来,达到显色效果,从而检测组织中的钙盐沉积。冯库萨染色由武汉长衍病理科技有限公司提供技术服务。切片在 Nicon 80i 正置显微镜下观察并拍摄图片(40×) , 并进一步用 Image J 软件测算冯库萨染色阳性(棕色)面积占切片总面积的百分比 (VK.A),以此反映小鼠骨钙化程度。1.6 马松染色(Masson staining) 取固定后的小鼠左侧股骨,用 EDTA 脱钙液对其进行脱钙处理,每3d更换1次脱钙液,待脱钙完成后进行石蜡包埋、切片和染色。马松染色由武汉长衍病理科技有限公司提供技术服务。染色切片在 Nicon 80i 正置显微镜下观察并拍摄图片(40×) , 进一步用 Image J 软件测算马松染色阳性(蓝色)面积占切片总面积的百分比 为胶原容积分数(CVF)。1.7 实验动物模型构建 成功标准基于上述动物实验和骨矿化相关方法检测分析多种骨形态学指标,设定模型构建成功的标准为:(1)成骨细胞活化,MAR增加。(2)骨胶原和骨基质合成增加。(3)骨骼钙盐沉积增多。(4)骨密度和骨量增加。1.8 统计学处理 采用 GraphPad Prism 8.0 软件进行统计学分析,两组间比较采用 t 检验分析。P<0.05 为差异具有统计学意义。2.1 PTH(1-34)诱导增加小鼠骨量 Micro-CT 检测发现,PTH(1-34)诱导20d后,PTH(1-34)处理组股骨远侧干骺端BV/TV(t=9.473,P<0.001)和Tb.Th(t=18.64,P<0.001)显著高于对照组,Tb.Sp(t=7.794,P<0.01)较对照组显著减小(图1)。2.2 PTH(1-34)增强小鼠成骨细胞活性、促进骨骼钙沉积并提高骨矿化率 在荧光显微镜下观察小鼠的非脱钙骨硬组织切片,发现 PTH(1-34)处理组骨骼携带的钙黄绿素荧光面积显著高于对照组(t= 29.99,P<0.001,图 2A)。且 PTH(1-34)处理组骨骼盐酸四环素-钙黄绿素双荧光间距大于对照组(图2B),通过双荧光间距计算 MAR,发现 MAR 显著增加(图2C)。对硬组织切片进行冯库萨染色,发现 PTH(1-34)处理组骨骼染色阳性面积显著高于对照组(t=29.99,P<0.001,图 3)。2.3 PTH(1-34)促进小鼠骨胶原合成 PTH(1-34) 处理组 CVF 显著高于对照组(t=13.94,P<0.001,图4)。骨矿化是骨组织发育和骨重塑过程中的重要一环,构建骨矿化小鼠模型可以为骨相关疾病和骨微环境研究提供实验基础和依据,有助于深入了解骨矿化过程中的细胞和分子机制,从而揭示骨质疏松症、骨折不愈合等的发病机制。骨矿化动物模型还能评估新药和治疗方法对骨矿化的影响。此外, 该模型还能够模拟骨微环境,研究骨微环境对肿瘤细胞迁移、定植和休眠的影响。本研究采用 Micro-CT检测分析小鼠股骨远侧干骺端BV/TV、Tb.Sp和Tb.Th,结果提示PTH(1-34)处理组小梁骨体积和骨量显著增加,表明PTH(1-34)处理20d可以显著增加小鼠的骨密度和骨量,促进小鼠骨骼发生高度矿化。盐酸四环素-钙黄绿素双荧光标记和冯库萨染色的结果表明,PTH (1-34)促进钙盐在小鼠骨骼中沉积,表明PTH(1-34)通过增强骨组织中成骨细胞活性、促进钙盐沉积进而促进小鼠骨骼矿化。马松染色结果表明,PTH(1-34)增加小鼠骨胶原的生成,说明PTH(1-34)诱导小鼠20d可以显著促进骨胶原和骨基质合成。这些结果表明,经过20d的PTH(1-34)诱导,小鼠成骨细胞活性增强,骨量增加,骨矿化率提高,表明该小鼠骨矿化实验动物模型构建成功,可用于骨相关疾病的实验研究。本研究采用的 Micro-CT是一种基于X 射线的成像技术,能够反映样本结构,并对小鼠骨骼进行重建,从而定量分析骨密度、矿化程度和表面积等多种参数。该技术目前广泛应用于多项骨相关研究[21-23]。 Micro-CT不仅适用于离体动物样本,也可用于活体小动物,可在实验中直接分析实验动物的某些骨骼结构以及骨密度等参数,从而减少实验动物的使用。然而,仅在骨骼矿化程度较高时,Micro-CT 才能获得可视化的观察结果。本研究在鉴定骨矿化时,采用了盐酸四环素-钙黄绿素双荧光标记法,将这两种染料在不同时间注射入小鼠体内。待小鼠解剖取出股骨后,在显微镜下可直接观察硬组织切片中的荧光,最终计算出MAR。本研究还应用冯库萨染色法检测小鼠骨组织的矿化程度,这一方法与双荧光标记法相似,均能在矿化早期检测到骨组织矿化。然而,这两种方法均需在未脱钙的硬组织切片上进行,这使得样本制备过程既复杂又耗时,且对技术要求较高,因此研究人员常常放弃采用硬组织切片。为此,本研究对骨组织样本进行了马松染色,染色包括骨组织脱钙、石蜡包埋、切片和染色等步骤。马松染色能够有效检测骨矿化过程中骨胶原的含量,且作为胶原纤维染色的标准方法,在检测胶原含量方面具有权威性。然而,马松染色操作较复杂,对技术要求较高。总之,本研究中多种骨矿化鉴定方法各有优缺点,且主要限于影像学和组织学鉴定,缺乏对骨矿化相关参数的定量生化分析,例如血清骨特异性碱性磷酸酶水平可反映骨形成、骨钙素水平可评估矿化过程。具体采用何种鉴定技术应根据研究目的及实验条件的不同而定。本研究也存在一定的局限性。生理条件下的骨矿化受维生素D[24-25]、雌激素[26-27]、PTH[28]等多种因素调节,本研究采用PTH(1-34)诱导模拟小鼠体内骨矿化,并不能反映除PTH以外的骨矿化调节通路。后续研究可以尝试其他因素调节小鼠骨矿化,构建小鼠实验动物模型。本研究仅采用PTH(1-34)诱导小鼠20d构建骨矿化模型,后续研究可以设置PTH(1-34)浓度梯度或时间梯度诱导产生不同的矿化程度,用于骨相关疾病和肿瘤骨转移研究。本研究只在小样本量小鼠中进行实验研究,后续可以结合构建小鼠骨组织不同矿化程度实验动物模型进行更大样本量的实验,以期获得更全面的结果。综上所述,通过构建小鼠骨矿化动物模型,可以进一步在细胞和分子水平上探索骨矿化机制及其调控因素,为防治骨质疏松症、骨软化症、肿瘤骨转移等临床问题提供实验依据。此外,本模型还可用于评估新药疗效及作用机制,推动临床治疗策略的开发。因此,进一步优化骨矿化小鼠动物模型和鉴定方法,不仅有助于基础研究,还能为临床转化提供有力支持。
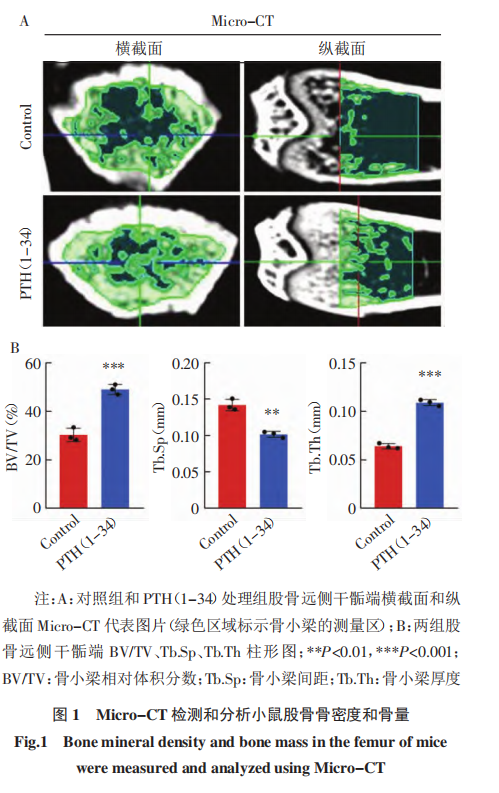
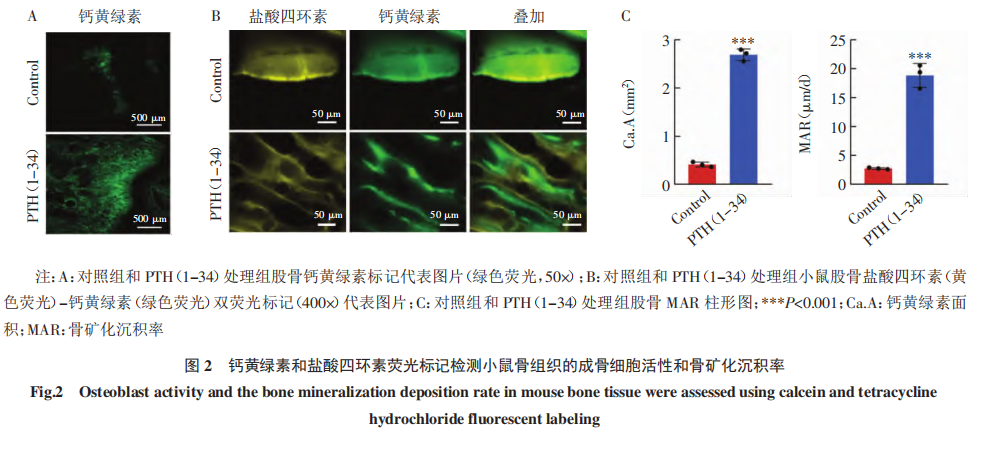
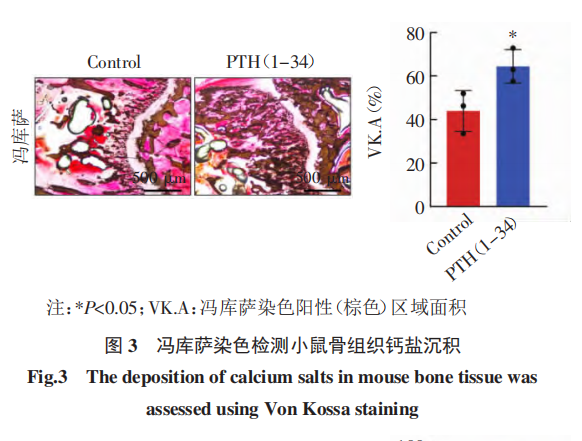

 官方微信
官方微信