中国口腔种植学杂志 2024 年 8 月第 29 卷第 4 期林振华,褚祥宇,魏振西,董传俊,赵增琳,孙晓霞,李庆雨,张琪(山东省医疗器械和药品包装检验研究院,国家药品监督管理局生物材料器械安全性评价重点实验室,济南 250101)
目的在临床前动物实验中确定适合猪的穿刺方法以及骨水泥的安全性及有效性评价方法。方法将24头实验用猪(体质量60~80 kg)随机分为A、B两组[A 组为Tecres 骨水泥组,B 组为不透射线骨水泥(Spine-Fix Radiopaque BoneCement)组],每组12头。在C型臂X射线机监视下,单侧椎弓根入路法经皮穿刺将材料植入到猪的腰椎L1和腰椎L4节椎体内,分别于术后4周、26周采用安乐死方法处死动物,取动物的腰椎L4节椎体进行抗压强度测试、取动物的腰椎L1节椎体进行硬组织病理学检查,观察植入部位的局部炎症反应、骨坏死情况与骨整合程度。结果 A、B两组之间抗压强度测试结果在4 周、26 周时均无统计学差异(P﹥0.05)。术后4周,A、B两组镜下均可见试验样品,均可见骨水泥被增生的纤维组织包裹,周边均可见以淋巴细胞浸润为主的炎症反应,均可见试验样品与骨组织结合,骨小梁排列紊乱,两组均可见成骨细胞及少量类骨质形成。术后26周,A、B两组镜下均可见试验样品,新生骨组织逐渐矿化,骨小梁逐渐融合,骨小梁结构变得规整致密,连续性变好,未见明显炎症反应。结论 A、B两组之间抗压强度、植入部位的局部炎症反应、骨坏死情况与骨整合程度均未见明显差异。[关键词]椎体成形术;骨水泥;骨填充材料;抗压强度;硬组织病理;骨整合;猪
随着人口老龄化的加剧,椎体相关疾病,如骨质疏松性椎体压缩骨折、椎体肿瘤等的发病率逐年上升,给患者的生活质量带来了严重影响。椎体成形术全称为经皮穿刺椎体成形术(percutaneous vertebro plasty,PVP)是临床上向病变椎体内注入骨水泥达到强化椎体的技术。椎体成形术作为一种微创手术技术,通过向椎体内注入骨水泥,增强椎体的强度和稳定性,从而达到缓解疼痛、恢复椎体高度、防止椎体进一步塌陷的目的,在临床上得到了广泛应用[1-4]。骨水泥作为一种骨原位修复生物材料,其特点是在室温或机体生理条件下能自行固化,其固化反应温和,生物相容性好,有良好的成骨性与骨结合。它可以直接注入体内骨缺损部位,并快速固化,对于骨缺损修复、骨折固定、骨质疏松治疗有重要价值[5-9]。Tecres 骨水泥是由意大利的 Tecres S.p.A 公司研发生产,这种骨水泥的成分主要是聚甲基丙烯酸甲酯,由粉剂和液体两部分组成,两者混合后自行聚合形成聚甲基丙烯酸甲酯。它采用革命性的 3:1 粉液比例,区别于传统的 2:1 比例;单体含量低于其他同类产品,毒性更低,安全性更高;含有高浓度的 X 光显影剂,在影像学检查中清晰可见。Spine-Fix Radiopaque 骨水泥是由 Teknimed S.A.S 公司生产。它作为一种不透射线的骨水泥,在普通骨水泥成分的基础上添加了一定的显影成分,使其在 X光或其他影像学检查下具有良好的显影效果,方便医生在手术过程中观察骨水泥的注入情况和分布状态。临床前动物实验作为医疗器械评价过程中的重要环节,能够为骨水泥在椎体成形术中的应用提供关键的安全性和有效性数据。本研究通过动物实验模拟人体生理环境和疾病状态,在椎体成形术中评价了骨水泥的安全性及有效性,为临床实验及骨水泥的临床应用提供了科学依据,对推动椎体成形术的发展、保障患者的健康具有重要意义。
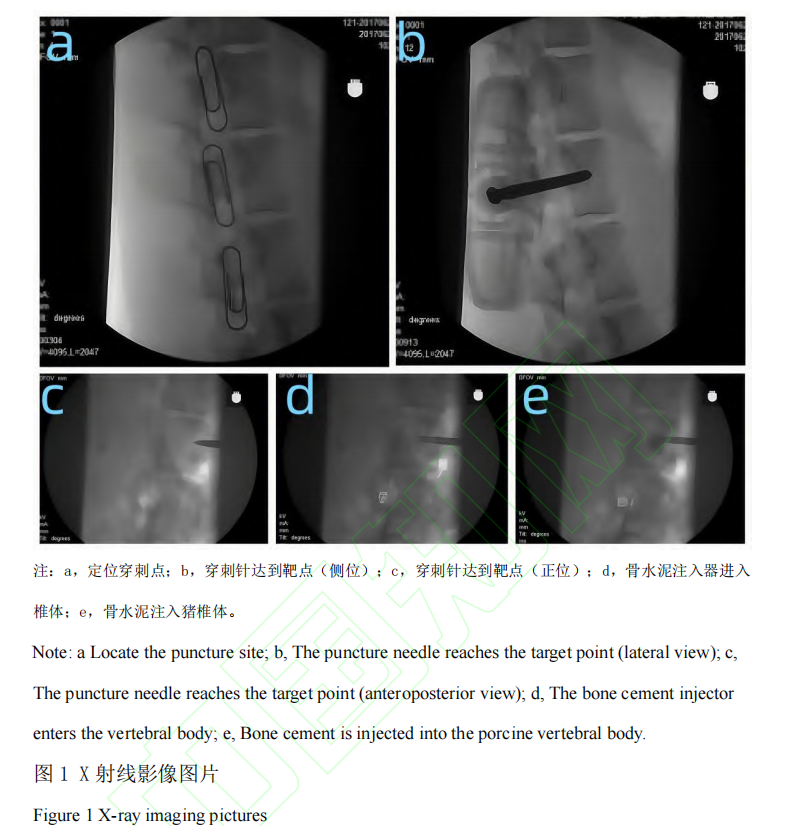
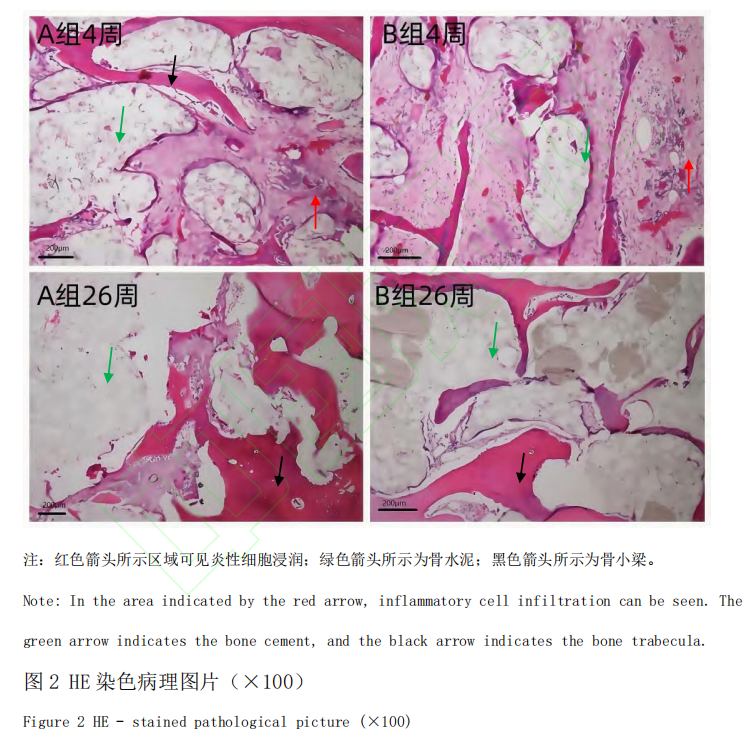
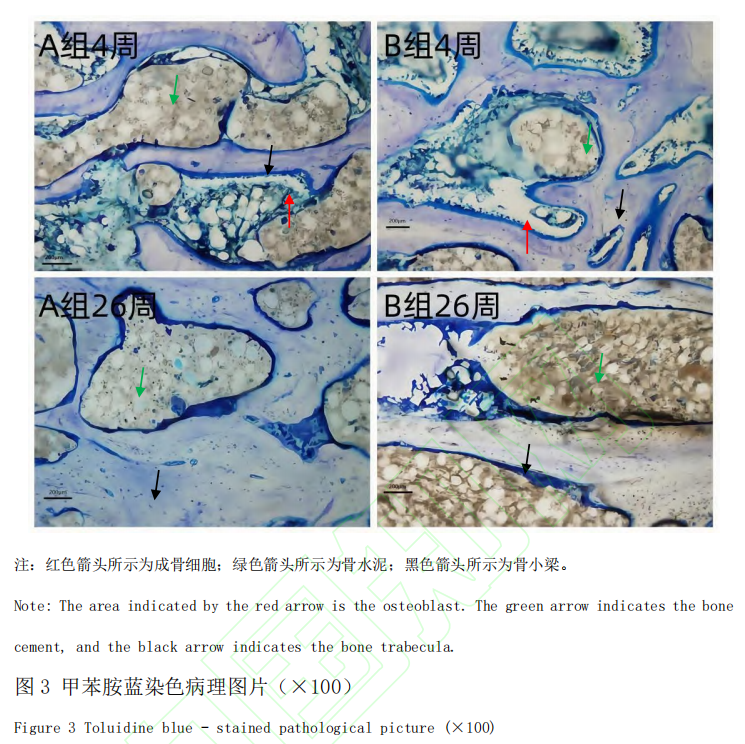
本研究选用从天津市百农实验动物繁育科技有限公司[SCXK(津)2020-0002]同批次购买的普通级实验用猪 24 头,雌(未孕)、雄不限, 年龄6~8 月,体质量 60~80 kg,质量合格证号为120904220100053648。24 头猪随机分为A 、B 两组(A 组为Tecres 骨水泥组,B 组为Spine-Fix Radiopaque Bone Cement 组),每组 12 头。实验周期设为 4 周和 26 周,每组每个周期 6 头猪。动物分组饲养在保育床中,由耳标号及卡片进行识别,卡片上分别标出动物编号和实验起止日期。动物实验在山东省医疗器械和药品包装检验研究院(原山东省医疗器械产品质量检验中心)开展,普通环境[SYXK(鲁)2023-0022](原实验动物使用许可证号:SYXK(鲁)2018-0017),适用普通级猪。饲养环境温度 16~26 ℃, 相对湿度 40%~70%。饲料及来源:小型猪配合饲料购自科澳协力(天津)饲料有限公司[SCXK(津)2020-0004]。饮水: 城市饮用自来水,自由饮水。实验过程中动物的处理符合山东省医疗器械和药品包装检验研究院制定的实验动物伦理委员会管理文件的要求,遵循中国实验动物相关法律法规条例要求。本研究获得山东省医疗器械和药品包装检验研究院动物管理及伦理委员会批准,实验过程中动物的处理符合伦理要求(伦理审批号 P20220331001)。呼吸麻醉机(型号 WATO EX-20,深圳迈瑞生物医疗电子股份有限公司),兽用便携式多参数监护仪(型号iMEC8 Vet,深圳迈瑞生物医疗电子股份有限公司),C型臂(型号HHMC系列,北京万东鼎立医疗设备有限公司),拉力试验机[型号5966,Instron,ADivision oflllinous Tool Works Inc.(美国)],全自动影像测量系统[型号SmartScope™ZIPLITE250,OpticalGagingProductsInc.(美国)],硬组织切片机(型号300CP,德国EXAKT公司),硬组织磨片机(型号400CS,德国EXAKT公司),正置显微镜(型号BX53/DP73,日本Olympus),Tecres 骨水泥(规格型号:1230、样品批号:AB1039、生产厂家:意大利TecresS.P.A、注册证编号:国食药监械(进)字2014 第3652518 号),Spine-Fix Radiopaque BoneCement(规格型号:粉体T040320S;液体T042320B、样品批号:粉体043S18152;液体043S18152、生产厂家:TEKNIMED S.A.S、注册证编号:国械注进20183461012),丙泊酚乳状注射液(迪施宁)(规格为20mL:200mg,生产批号为5A210333,广东嘉博制药有限公司,国药准字H20051842),异氟烷(宠物用)(规格为100mL,生产批号为20210501,江苏恒丰强生物技术有限公司,兽药字101357015),注射用头孢噻呋钠(规格0.5g×10 支,江西博莱大药厂有限公司,生产批号为 20220302,兽药生产证字 14006 号)。动物术前 24 h 禁食不禁水。按 0.5 mL/kg 的剂量,通过耳静脉一次性注射丙泊酚注射液进行诱导麻醉。诱导麻醉后,进行气管插管,连接呼吸麻醉机,使用异氟烷(2%)气体维持麻醉。动物侧卧位,于腰椎区备皮,备皮区约 40 cm×50 cm,清洁后用碘伏进行消毒,铺上中单、洞巾等,暴露穿刺部位。C 型臂 X 射线机定位穿刺点后,用手术刀在穿刺点切开一个约 5 mm 的穿刺口,穿刺针依次通过皮下脂肪层、肌肉层,在 C 型臂 X 射线机引导下,达到靶点后,使用扩张钻缓慢扩张旋转,使 L1 、L4 椎体形成一个相对疏松的空腔,完成扩张。分别对猪的腰椎 L1 、L4 节椎体植入实验材料。小心打开粉末袋,将所有粉末倒入搅拌器中;打开液体瓶盖,用注射器吸取液体,注入粉末中,小心搅拌,避免气泡产生,直至形成均匀混合体(骨水泥一般按照粉末 10 g:液体 5 mL 的比例调配)。根据产品说明书提示,待骨水泥呈稀粥样时吸入专用注射器,待其呈牙膏状时,迅速使用骨水泥注入器,经通道注入椎体,注射量约为1 mL(图1)。其中 A 组动物植入 Tecres 骨水泥,B 组动物植入 Spine-Fix Radiopaque Bone Cement骨水泥。拔出穿刺针套管,穿刺点局部压迫 3~5 min 后,将创口缝合,常规消毒。术后肌肉注射 0.25 g(以头孢噻呋计)的注射用头孢噻呋钠,防止感染。连续 3 d, 1 d 两次。术后 4 周和 26 周分别处死各组动物 6 头,将腰椎 L1 、L4 周围软组织清除干净,切除棘突、横突及椎间盘,保留完整椎体。腰椎 L4 进行椎体接触面积的计算,使用拉力试验机在 5 mm/min 的速度下将椎体压至断裂,记录压力。椎体断裂前最大力值为椎体抗压值。计算出单位面积的抗压值。将腰椎 L1 浸泡于体积分数10%甲醛固定液内,充分固定后,浸泡于乙醇脱水,树脂包埋,采用硬组织切片技术进行切片。通过 HE 染色,光学显微镜下观察各时间点 L1 腰椎局部炎症反应及骨坏死情况(镜下观察不到完好的骨小梁结构视为骨坏死)。通过甲苯胺蓝染色,光学显微镜下观察骨水泥与周围骨间有无骨小梁长入来判断骨整合度。对椎体抗压强度测试结果进行统计。计量资料以平均值±标准差(x ± SD )表示。两组样本均数间比较用单因素方差分析。数据结果采用 SPSS22.0 统计软件进行处理分析。P﹤0.05 认为差异有统计学意义。在 4 周时,对 A 组与 B 组椎体(L4)抗压强度进行测试,A 组(n=6)抗压强度结果平均值为(15.45±2.59)MPa,B 组(n=6)抗压强度结果平均值为(15.32 ±3.16)MPa,两组之间无统计学差异(P﹥0.05);在 26 周时,对 A 组与 B 组椎体(L4)抗压强度进行测试,A 组(n=6)抗压强度结果平均值为(16.67±3.31) MPa ,B 组(n=6)抗压强度结果平均值为(14.73±2.62)MPa,两组之间无统计学差异(P﹥0.05)。A 组术后 4 周时,镜检观察可见,植入的骨水泥被增生的纤维组织包裹,周边可见以淋巴细胞浸润为主的炎症反应。术后 26 周时,镜检观察可见骨水泥植入周围,未见明显炎症反应,术后 26 周骨小梁排列规则整齐,样品与原骨组织间夹杂的纤维组织减少(图2)。B 组术后 4 周时,镜检观察可见骨组织被增生的纤维组织包裹,周边可见以淋巴细胞浸润为主的炎症反应。术后 26 周时,镜检观察可见骨水泥-骨界面结合处基本无纤维组织,交界处无炎性细胞浸润,骨小梁排列更加规则致密整齐(图2)。A 组术后 4 周时,镜检观察结果显示骨小梁不连续,可见呈深蓝染的成骨细胞,并有少量新生的类骨质形成,骨小梁粗细不均一,排列紊乱,可见呈淡蓝染的纤维样组织。术后 26 周时,镜下可见,椎体骨小梁宽度增加,纤维样组织消失,被新生的成熟的骨组织取代,骨小梁更加规则致密整齐(图 3)。B 组术后 4 周时,镜检观察结果显示骨小梁间隙可见骨水泥,骨小梁排列紊乱,可见呈深蓝染的成骨细胞,有少量新生的类骨质形成,可见呈淡蓝染的纤维样组织形成,骨小梁不连续。术后 26 周时,镜下可见,骨小梁逐渐融合,变得连续,排列更加规整,纤维样组织消失,新生骨组织矿化程度高,新生骨组织逐渐趋于成熟(图 3)。椎体成形术是增强椎体生物力学强度、防止塌陷、缓解疼痛的微创脊椎外科技术,其核心原理是通过经皮穿刺,将骨水泥注入病变椎体内。在椎体因骨质疏松、肿瘤侵袭等原因发生骨折或骨质破坏时,椎体的力学结构遭到破坏,承载能力下降。骨水泥注入后,能在椎体内迅速填充骨小梁间隙,待其固化后,如同在椎体内构建起一个坚实的“内支架”,恢复椎体的强度与刚度,重新为脊柱提供稳定支撑,进而有效缓解因椎体不稳定引发的疼痛[10-14]。临床前动物实验中评价骨水泥的重要手段。当前研究虽然成果丰硕, 但局限性亦存。多数椎体成形术临床前动物实验的随访时间相对较短, 往往集中在术后数周或数月,难以全面反映骨水泥在体内长期存在所引发的一系列变化。骨水泥的降解过程是一个渐进且复杂的生物学过程,短期试验无法准确捕捉其在数年甚至数十年尺度上的降解速率、降解产物代谢以及由此对周围组织微环境造成的动态影响。随着时间推移,骨水泥的力学性能逐渐衰减,而现有的短期研究无法精准预测这种衰减趋势在长期内是否会导致椎体稳定性的丧失,进而引发临近椎体骨折、脊柱畸形等远期并发症[15-17]。在椎体成形术及骨水泥研究领域,国内外存在诸多差异。国外在该领域起步早,积累了丰富的研究经验和临床数据。早期,国外学者就对手术技术和骨水泥应用展开探索,随着临床实践的增加,研究重点逐渐转向骨水泥性能、安全性及有效性。在骨水泥安全性方面,国外研究关注其生物相容性、毒性以及对周围组织和全身系统的影响。在有效性方面,国外研究致力于提高骨水泥力学性能,优化配方和注入技术,以减少术后椎体再骨折风险。国内研究起步相对较晚,但发展迅速。在手术技术上,国内学者借鉴国外经验,结合我国患者特点进行优化创新,提高了手术成功率和安全性。在骨水泥研究方面,一方面深入研究传统骨水泥性能,分析骨水泥渗漏原因及防治措施;另一方面加大新型骨水泥研发投入,将纳米技术、生物材料等应用于骨水泥制备,改善其生物相容性、力学性能和骨传导性。在动物实验研究中, 国内也重视利用实验猪等大动物模型评估骨水泥性能。本研究通过开展猪的椎体成形术动物实验,能够精准模拟临床操作流程,深入探究手术器械在椎体内的实际工作状态,通过骨水泥注入椎体后的系列研究,为骨水泥的安全性和有效性评估提供至关重要的依据。结果表明 A、B 两组之间抗压强度、植入部位的局部炎症反应、骨坏死情况与骨整合程度均未见明显差异。A 组与 B 组在术后 4 周时,镜下均可见骨水泥被增生的纤维组织包裹,周边均可见以淋巴细胞浸润为主的炎症反应,均可见试验样品与骨组织结合,骨小梁排列紊乱,两组均可见成骨细胞及少量类骨质形成。A 组、B 组在术后26周时,镜下均可见试验样品,新生骨组织逐渐矿化,骨小梁逐渐融合,骨小梁结构变得规整致密,连续性变好,未见明显炎症反应,两组之间未见明显差异。
 官方微信
官方微信