文章来源:中国知网
( 1 延边大学附属医院骨科中心脊柱外科, 吉林 延边 133000;2 吉林省电力医院神经介入科)〔 关键词〕 脂肪间充质干细胞 ;藻酸盐微粒 ;水凝胶三维支架 ;骨再生 ;颅骨缺损模型〔文章编号〕 1005-9202(2025)13-3196-05;doi:10. 3969/j. issn. 1005-9202. 2025. 13. 031
骨骼在人体中起到支撑作用 ,通过关节、肌肉及韧带等组织连成一个整体。同时骨骼对人体有保护作用,人类的骨骼被皮肤、肌肉等包裹的同时,也保护着人体内重要的脏器,避免外力的影响甚至造成损伤。此外,骨骼也主导着运动,正是因为骨骼与肌肉、肌腱、韧带等组织相协同,共同完成人的运动功能。然而因外伤、先天性畸形、肿瘤及感染等情况导致的骨缺损的修补与重建是骨科、颅脑外科、整形外科等领域治疗的重点和难点〔1〕。尽管小范围的骨缺损,可由机体缓慢自行修复,但大面积的骨质缺损往往需要外科手术等进行干预。目前,临床修复骨缺损的方法主要包括自体骨移植、异体骨移植及合成生物材料移植〔2,3〕。其中合成生物材料及自体骨移植应用较多〔4~6〕,但其使用存在诸多局限性,如供体骨区发病率高、长期疼痛、排异反应严重,以及人体自身骨质有限导致可用性不足等可能性〔7,8〕。以上情况均会影响骨缺损的修复效果。鉴于骨缺损修复的局限性及尽可能在微环境下进行骨缺损修复的需求 ,本次实验采取脂肪间充质干细胞(ADSCs)联合三维(3D)水凝胶支架的共同培养的方式,以加速骨细胞分化和形成,诱导骨再生。在正常生理环境中,成骨细胞、骨细胞、干细胞,可通过细胞间的直接接触和可溶性因子相互作用〔9~ 11〕。此外,需要使用生物支架模拟天然 3D环境,提高了植入缺损部位的细胞活力。为模拟骨组织的微环境并加速成骨细胞分化,多种共培养系统已被开发。如跨孔共培养系统用于干细胞和成骨细胞之间的精细研究〔12〕。3D 共培养模型可以进一步观察到基本生物学进展和趋化作用。考虑到递送生长因子的重要性,用于干细胞分化的细胞因子持续递送技术也趋于完善。合成水凝胶支架的步骤中可产生高度可调和和单分散的微粒,可保持其高度的稳定性〔13〕。此外,水凝胶支架可以保护封装的细胞和药物免受意外输送的副作用〔14〕,并且微凝胶中的细胞可以增强旁分泌效应〔15〕。本研究构建了一种基于胶原水凝胶的新型三维间接共培养系统,探索其对细胞增殖活力及干细胞分化成成骨细胞的功效,并与传统的生长因子在颅骨缺损模型中对基于干细胞的骨再生的作用进行了比较。
1. 1 动物及分组 选取 21只 8 周龄雄性Sprague Dawley(SD)大鼠(体质量 240 ~260g) ,该动物研究获得了国际动物护理和使用委员会(首尔大学波拉美医院动物伦理委员会,SMG-SNUIACUC:2017-0031)批准。经过 7d的适应期后进行实验。向所有动物提供充足的水和食物,饲养在12 : 12暗/光循环和无特定病原体(SPF) 的笼中。将21只大鼠随机分为Col-ADSC组、Col-ADSC-E1组、 Col-ADSC-BMP 组各 7只。随后进行各组支架的制备。1. 2 准备支架 Col-ADSC组通过静电液挤压法(NanoNC,#ESR100D)制备海藻酸盐微粒。将藻酸盐溶解于去离子水中,配制成 2 重量百分比(wt%)的溶液。然后,通过 27 号不锈钢针以 5ml/h的连续流速向含有藻酸盐溶液的注射泵施加 9kV电势,使藻酸盐溶液从针上滴下, 收集在最底部的75mmol/L氯化钙溶液底部。用磷酸盐缓冲液(PBS)洗涤收集的藻酸盐微粒。对于细胞研究,在冰浴中将藻酸盐微粒与 5wt%胶原溶液(Corning,#354249)混合,转移至定制的 8mm直径模具中,然后用1mol/L 的 NaOH 中 和, 在下37 ℃下温育30min 使胶原溶液凝胶化。此将ADSCs 包埋在胶原水凝胶支架中为Col-ADSC组。Col-ADSC-E1组为在胶原支架中开发共培养系统,采用静电液滴挤压法制备了包裹成骨细胞的海藻酸盐微粒(E1)。首先,将0.5ml 成骨细胞悬浮液(5×105cell/ml)与1. 5ml,2wt%藻酸盐溶液混合,在 9kV电势下滴下。用 8s收集E1,并将20mlADSCs悬浮液(2× 105cell/ml)与含有 E1的胶原溶液混合,包封在单一支架中。随后在37℃下对共培养的胶原支架 Col-AD- SC-E1 进行中和并凝胶化。Col-ADSC-BMP组关于骨形态发生蛋白(BMP)对ADSCs的作用,使用相同的方法将BMP (R&DSystems,#GF166) (5μg/ml)在静电液滴挤压过程中包封在 E1中。简而言之,使用 0. 5mlBMP-2 悬浮液(5μg/ml)和 1ml2wt%海藻酸盐的混合溶液,并在 9s内收集BMP-2 封装微粒,以封装在单个支架中。1. 3 支 架 置 入 21只大鼠均予以麻醉 , 采用20 mg/kg的Zoletil舒泰(VIRBACS. A.,Carros,法国)和10mg/kg的盐酸塞拉嗪(BayerKoreaCo.,安山,韩国)配比后腹膜内注射。麻醉生效后,头部术区备皮,用10%的碘伏溶液消毒手术部位。在头皮上做纵向切口,充分显露颅骨,用环锯制造直径为8mm的圆形骨缺损。用生理盐水冲洗缺损部位后,分别 对Col-ADSC 组、Col-ADSC-E1 组、Col-ADSC- BMP组进行支架植入,分组标记后用 4-0 尼龙线缝合头皮切口。术后 2d 注射100mg/kg的头孢唑林抗生素(ChongKunDangCorp.,首尔,韩国)预防感染。所有动物于术后第 6 周后在深度麻醉下使用CO2 室处死,获取标本,并立即固定在 10%甲醛溶液中,用于组织学检查和显微计算机断层扫描(micro- CT)评估。1. 4 微型 CT (micro-CT) 使用SkyScan 1172CT扫描仪扫描。扫描仪参数设置为图像像素尺寸13. 38mm、源能量59kV、0. 5 mmAI过滤器、电流167 μA和旋转步长0. 451 °。使用NRecon软件(Bruker,Belgium,V1. 7. 0. 4 ) andmicro-CT( Sky-Scan,Bruker,Belgium,V1.17. 7. 2+) 进行图像重建和CT 分析。以冠状面上的 8mm圆形直径作为重点评价区域,评估新骨形成。分析的骨形态参数为骨体积百分比(BV/TV)、骨小梁模式因子(Tb. Pf)、骨小梁厚度(Tb. Th)、骨小梁数(Tb. n)、骨小梁分离(Tb. Sp) ,骨表面积/体积比(BS/BV) ,结构模型指数(SMI)和各向异性程度(DA)。1. 5 组织学 标本用 10%甲醛溶液固定,用 80%~100%乙醇脱水,浸入到脱水样品中并包埋在 Techn- ovit7200(EXAKT,德国)树脂中。使用聚合系统来固化样品制成蜡块。用EXAKT 切割机(EXAKT,德国)将蜡块切成200μm 厚的切片。使用EXAKT 研磨系统(EXAKT,德国)将切片研磨30~50μm。切片用 VonKossa 染色,并用显微镜观察新骨形成。1. 6 统计学分析 采用 SPSS20. 0 软件进行方差分析 ,两两比较行进行 Tukey 检验。
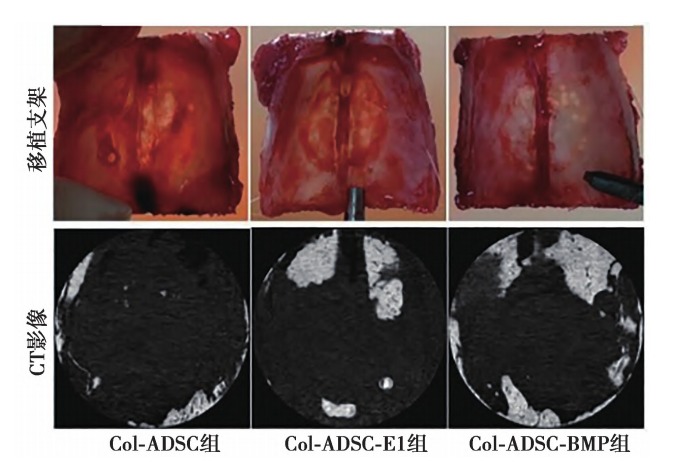
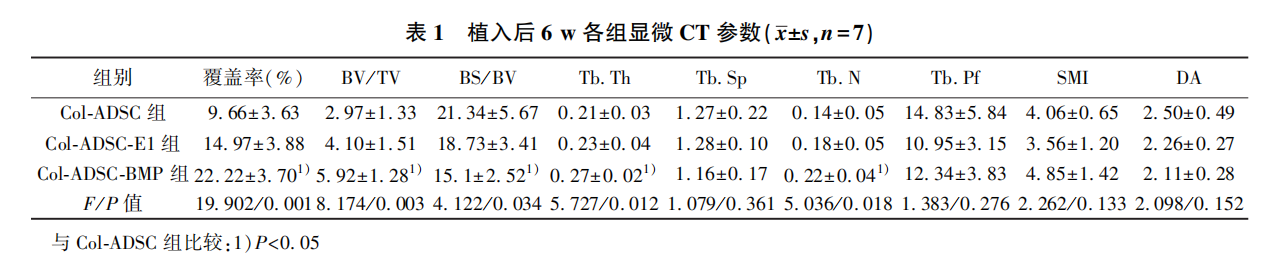
2. 1 显微CT 结果在实验过程中,所有动物未出现炎症、感染或死亡现象。6w 后,获取缺损部位组织,发现Col-ADSC-BMP组和Col-ADSC-E1组在边缘区域均呈现出骨组织重建的迹象(图1)。Col- ADSC-BMP 组缺损部位覆盖率组明显高于Col-AD- SC 组(P = 0. 001) ,见表1。Col-ADSC-BMP组高于Col-ADSC 组,Tb. Th、Tb、N明显高于Col-ADSC组,BS/BV明显低于Col-ADSC组, BS/BV 明显低于Col-ADSC 组(P<0. 05)。见表1。BV/TV,Tb. N和Tb. Th 在Col-ADSC-BMP组中显示较高数值,而在Col-ADSC-E1 组中略有增加。这一结果充分证明,在相同条件下, Col-ADSC-BMP组成骨效果优于Col-ADSC-E1 组。
2. 2 组织学检查 VonKossa 染色结果显示,各组均有新骨组织形成。其中,Col-ADSC-BMP组和Col-ADSC-E1 组新形成的骨厚度和长度方面更为显著,而 Col-ADSC 组在缺损部位的新骨形成量最少,仅 限于宿主骨的边缘 ( 图2 ) 。在Col-ADSC-BMP组和Col-ADSC-E1 组中,Col-ADSC-BMP组骨厚度明显高于Col-ADSC-E1 组。结果可以明确得出 Col-ADSC-BMP组比Col-ADSC-E1组具有更好骨再生功能,在缺损部位能够观察到稍多的新骨形成。

已有文献也证明了成骨细胞通过 2D 直接共培养诱导 ADSCs 的成骨分化〔16〕. 也有文献证实 ,成骨细胞最初刺激间充质干细胞增殖 ,并在成骨培养环境中诱导成骨〔17 ,18〕。与共培养相比 ,3D 共培养微环境对支持活跃细胞功能更为重要〔19〕。本研究表明,成骨细胞和骨源性细胞可以诱导干细胞的成骨分化,骨髓间充质干细胞(MSCs)向成骨谱系的分化由微环境中复杂的调节因子决定。BMP-2、4、6和 7是成骨细胞MSC分化的重要介质〔20〕。BMP的细胞内效应通过与细胞表面骨形态发生蛋白受体( BMPR)的相互作用来调节,BMPR的骨形成蛋白IB 型的激活对成骨分化至关重要。当BMPR 被激活时,触发 Runx2 基因途径,增强骨基质的形成,启动成骨分化。尽管在本研究中,BMP在Col-ADSC-E1 组和 Col-ADSC-BMP 组中的释放相似,但是高成骨作用可能是由各种细胞因子共同作用的结果,包括成骨细胞释放的TGF-b 家族成纤维细胞生长因子(FGF)-2 和胰岛素样生长因子〔21〕。就 3D 仿生微环境对于细胞行为和组织再生的重要意义来看〔22〕,共培养系统需要构建能容纳各种细胞类型的3D平台〔23〕。本研究显微CT 图像和组织学结果共同表明,当与 Col-ADSC-BMP组、Col-ADSC-E1组共培养时,支架中的MSCs完成了成骨分化。然而,值得注意的是,MSCs在Col-ADSC-E1组中的成骨作用低于体外结果。这可能是由于在大鼠体内环境中移植小鼠来源的成骨细胞和人来源的间充质干细胞引起的免疫排斥。另有研究发现,骨缺损模型中的异种移植引起免疫活性,进而阻碍骨再生〔24,25〕。这一结果表明解决植入物的免疫原性对于最大程度利于骨组织的再生效果至关重要。此外,这些样品是在植入后 6 w 收集的,这可能意味着这是无任何外源性因素干预下MSCs成骨的一个培养周期。因此,有必要进一步开展同种异体细胞和长期体内实验研究,以深入探究在没有任何人工因素的共培养系统中骨组织完全形成的过程。尽管如此,作为一种有潜力的治疗手段,间接共培养系统相较于只有AD-SC的培养系统相比,已被证实对骨组织再生更为有效,充分证明了通过模拟没有外源性因子如BMP的骨组织微环境,能够增强骨组织再生能力。该系统有望成为研究 3D 微环境中不同类型细胞间旁分泌效应的有力工具。在本研究中 ,成功构建了一种基于水凝胶支架的新型间接 3D 共培养系统 。在该系统中 ,成骨细胞在无任何外源性因素的情况下成功诱导 ADSCs成骨分化 ,这是干细胞治疗骨再生领域的一项积极成果 。最终 ,通过大鼠颅骨缺损模型对比间接共培养组与ADSC单一培养组的成骨作用 ,发现间接共培养组表现出更优的成骨效果 。水凝胶支架有望为患者制定符合解剖学形状的骨替代物 , 以实现最佳的骨再生效果 ,推动患者健康状况的改善 。间接共培养系统这一全新概念可为细胞通讯研究提供有效工具 , 同时也为组织再生构建了体外组织平台。



 官方微信
官方微信